প্রাসঙ্গিক প্রশ্ন
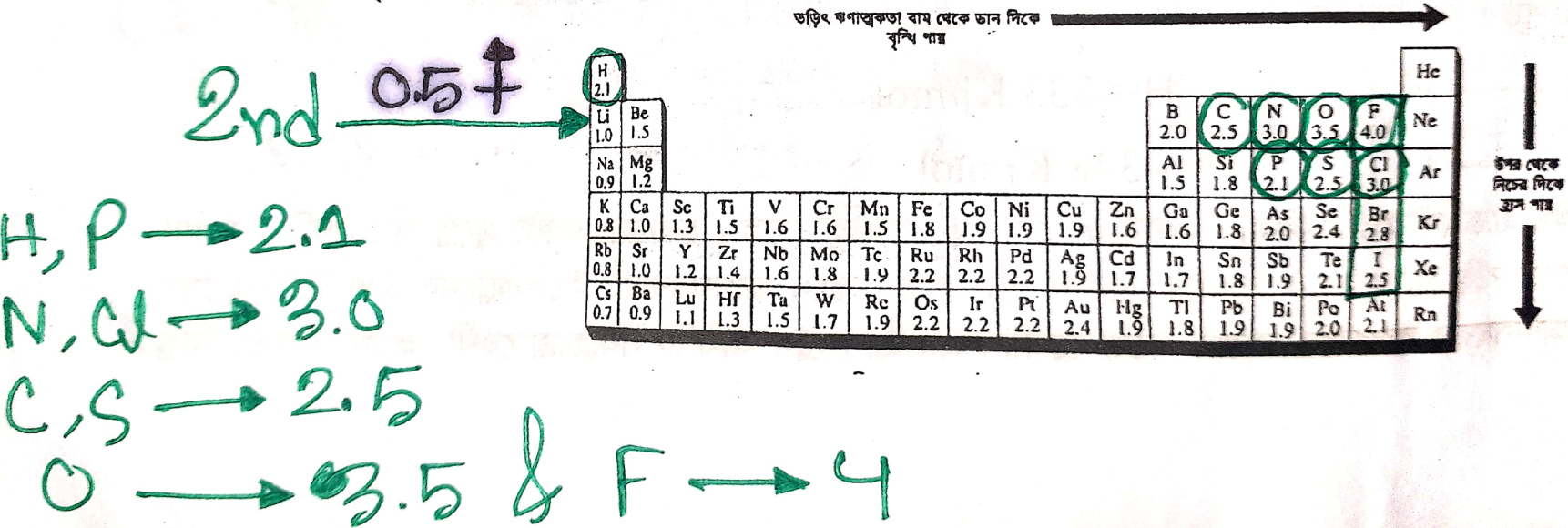
সর্বাধিক তড়িৎ ঋনাত্বক মৌল-
1.00
ফ্লোরিন সর্বাধিক তড়িৎঋণাত্মক মৌল :-
কোন সমযােজী যৌগের অণুতে বিদ্যমান শেয়ারকৃত ইলেকট্রন যুগলকে একটি পরমাণু তার নিজের দিকে আকর্ষণ করার ক্ষমতাকে তড়িৎ ঋনাত্বকতা বলে।পরমাণু আকার যত ছােট হয় ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণও তত বেশী হয় ফলে তড়িৎ ঋনাত্মকতা বেশী হয়। আবার নিউক্লিয়াস ও বাইরের কক্ষপথের মাঝে অবস্থিত কক্ষপথ সংখ্যা যত বেশী হয়, বহিস্থ স্তরের ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ তত কম হয় এবং তড়িৎঋণাত্মকতার মান তত কম হয়। এছাড়া অষ্টক পূর্ণতার কাছাকাছি বিন্যাসের মৌলগুলাে (যেমন -ns2np5) পূর্ণতা লাভের প্রবনতার কারণে তড়িৎঋণাত্মকতা বেশী হয় । F এর ইলেকট্রন হল -
F(9)-1s22s22p3
উপরের ইলেকট্রন বিন্যাস থেকে দেখা যাচ্ছে যে, অষ্টক পুরণ করার জন্য F এর 1 টি ইলেকট্রন দরকার এবং F পর্যায়ের সর্বডানে এবং শ্রেণির সবচেয়ে উপরের মৌল। একারণে নিয়মানুযায়ী ফ্লোরিন সবচেয়ে আকারে ছােট। তাই ফ্লোরিন সবচেয়ে বেশী তড়িৎঋণাত্মক মৌল।
CCl₄ আর্দ্র বিশ্লেষিত হয়না কেনো?
1.00
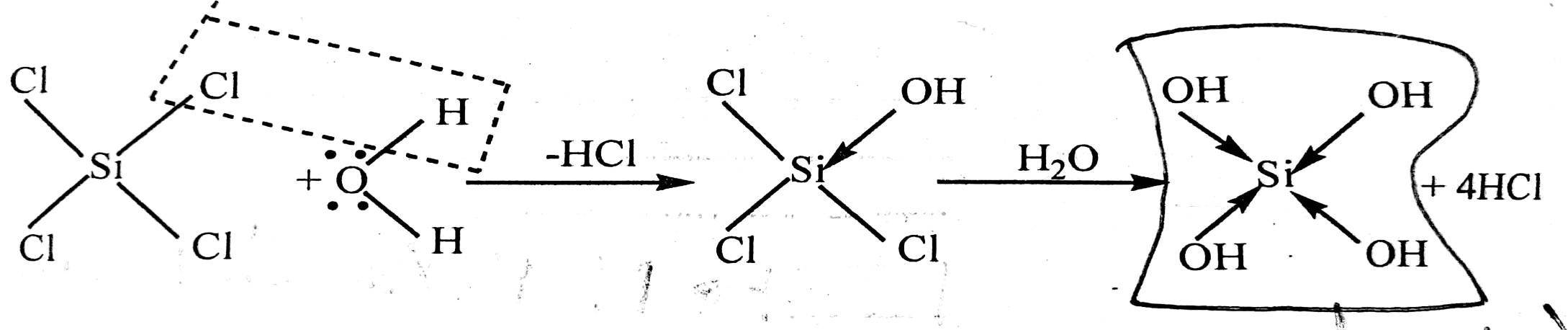
SiCl₄ আর্দ্র বিশ্লেষিত হয় বাট CCl₄ হয়না।আর্দ্র বিশ্লেষন→পানির সাথে বিক্রিয়া
কার্বন ও সিলিকন একই গ্রুপের(Gr-16)দুটি মৌল।তাদের ইলেকট্রন বিন্যাস হলাে -
C(6)—1s²2s²2p²
Si(14)-1s²2s²2p⁶3s²3p²3dº
কার্বনের ইলেকট্রন বিন্যাস থেকে দেখা যাচ্ছে যে, কার্বনের বহিস্তরে কোনাে ফাঁকা d অরবিটার নেই। ফলে CCl₄ কে পানিতে দিলেতা পানির অক্সিজেন পরমাণু থেকে মুক্তজোড়(3 জোড়া থাকে) ইলেকট্রন গ্রহণ করতে পারে না, ফলে পানির অণু কার্বন পরমাণুর সাথে সন্নিবেশ বন্ধন গঠন করতে পারে না। তাই CCl⁴ পানিতে আর্দ বিশ্লেষিত হয় না।
CCl₄+ H₂O→ No Reaction
অপর পক্ষে সিলিকনের ইলেকট্রন বিন্যাসে ফাকা 3d অরবিটাল থাকায় SiCl₄ কে পানিতে দিলে সিলিকন পরমাণুর অষ্টক সম্প্রসারন ঘটে এবং পানির অক্সিজেন পরমাণুর মুক্তজোড় ইলেকট্রনের সাথে সন্নিবেশ বন্ধন গঠন করে।
সন্নিবেশ বন্ধন গঠন একটি উচ্চ তাপউৎপাদী প্রক্রিয়া হওয়ায় উৎপন্ন তাপের প্রভাবে Si-Cl ভেঙ্গে Cl আয়ন সৃষ্টি করে। ফলে Si-Cl স্থলে Si-OH বন্ধন গঠিত হয়। এভাবে এক এক করে Si-Cl এর চারটি বন্ধন ভেঙ্গে তদস্থলে চার অণু সন্নিবেশিত পানি থেকে চারটি -OH মূলক প্রতিস্থাপিত হয় অর্থাৎ SiCl₄ আর্দ্র বিশ্লেষিত হয়ে Si(OH)₄ উৎপন্ন করে।
কোনটি বিদ্যুৎ পরিবাহী?
1.00
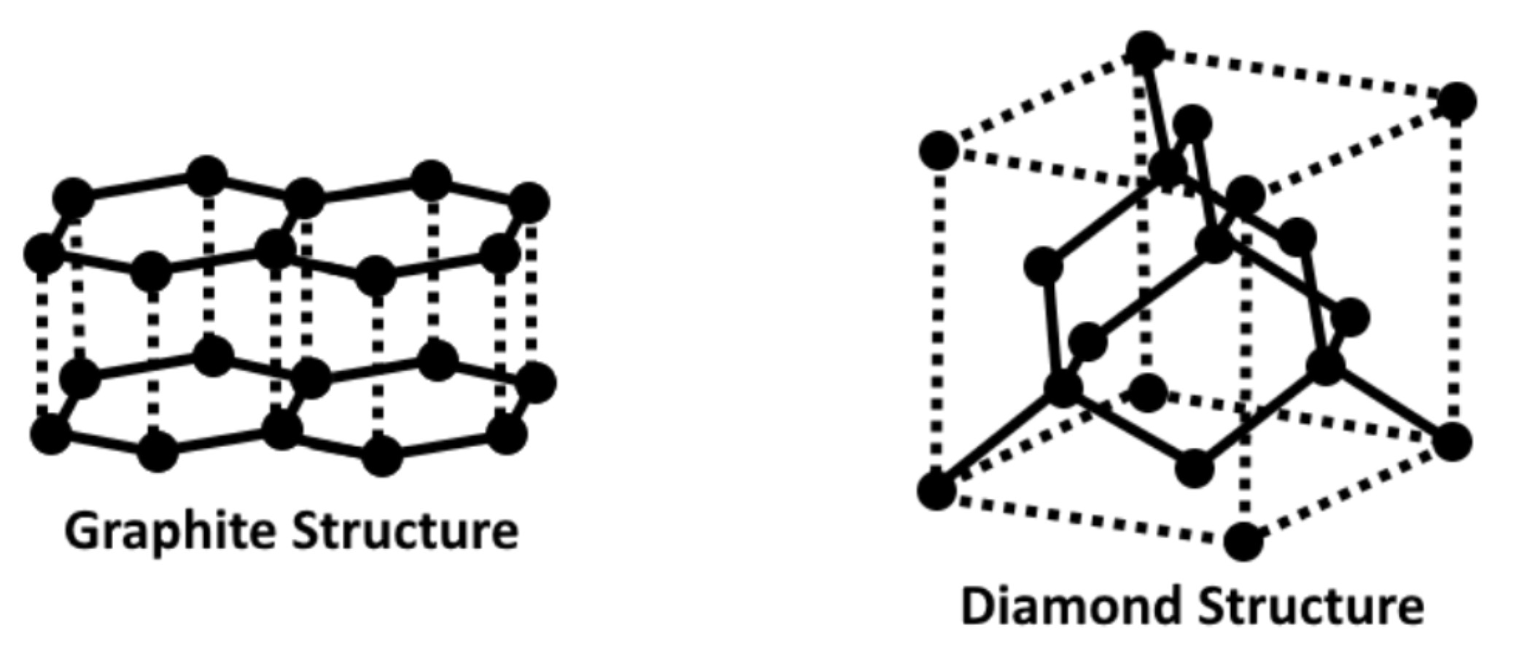
গ্রাফাইটের গঠনে প্রতিটি কার্বন পরমাণুতে sp2 সংকরণ দ্বারা তিনটি সংকর অরবিটাল ও একটি অসংকরিত অরবিটাল থাকে। গ্রাফাইটে এ তিনটি সংকর অরবিটাল দ্বারা প্রতিটি কার্বন পরমাণু অপর তিনটি কার্বন পরমাণুর সাথে সিগমা বন্ধন দ্বারা যুক্ত হয়। ফলে গ্রাফাইটে অসংখ্য কার্বন পরমাণু সহকারে ষড়ভুজী জালের সমতলীয় শীট বা স্তর সৃষ্টি করে থাকে। প্রতিটি স্তরে এরূপ ষড়ভুজ জালের সৃষ্টি হয়।এসব C-C বন্ধন সৃষ্টির পরেও প্রতিটি কার্বন পরমাণুতে একটি করে ইলেকট্রনযুক্ত অসংকরিত 2p¹ অরবিটাল অব্যবহৃত থেকে যায়।এ অরবিটালসমূহ পরস্পরের সাথে সংযুক্ত হয়ে এমন অবস্থার সৃষ্টি করে যে তাদের π-ইলেকট্রনগুলাে একই স্তরে সমগ্র জালিতে সঞ্চারণ করতে পারে। এ সঞ্চরণশীল ইলেকট্রনের কারণেই গ্রাফাইট বিদ্যুৎ পরিবাহী হয়। গ্রাফাইটের ন্যায় হীরক কার্বনের একটি রূপভেদ হলেও এদের ধর্মে খুবই পার্থক্য বিদ্যমান। এর কারণ এদের অণু মধ্যস্থ বন্ধন প্রকৃতি।হীরকের প্রতিটি কার্বন পরমাণুর sp3 সংরকরণ ঘটে। চারটি সংকরণ অরবিটাল একটি চতুস্তলকের চারটি কোণের দিকে প্রসারিত, যার কেন্দ্রস্থলে কার্বন পরমাণুটি অবস্থিত। এ চারটি সংকর অরবিটাল অপর চারটি কার্বন পরমাণুর সাথে চারটি সিগমা বন্ধন সৃষ্টি করে। ফলে প্রতিটি কার্বন পরমাণু অপর চারটি কার্বন পরমাণু দ্বারা চতুস্তলকীয়ভাবে পরিবেষ্টিত ও সিগমা বন্ধনযুক্ত থাকে। এভাবেই একটি অতি বৃহৎ ত্রিমাত্রিক অণু গঠিত হয়, যা হীরকরূপে দেখা যায়। যেহেতু প্রতিটি sp3 সংকরিত কার্বন পরমাণুর সব যােজ্যতা ইলেকট্রন অপর চারটি কার্বন পরমাণুর সাথে সিগমা বন্ধন সৃষ্টিতে ব্যবহৃত হয় এবং এতে কোন মুক্ত বা সঞ্চরণশীল ইলেকট্রন থাকে না, সেহেতু হীরক বিদ্যুৎ অপরিবাহী।
কোনটি পানিতে বেগুনী রং ধারণ করে?
1.00
আয়োডিন একটি রাসায়নিক মৌল যার রাসায়নিক চিহ্ন I এবং এর পারমাণবিক সংখ্যা ৫৩। এটি একটি গ্রিক শব্দ ἰοειδής ioeidēs থেকে এসেছে যার অর্থ বেগুনি বা রক্তবেগুনী। এই মৌলটি ১৮১১ সালে আবিষ্কৃত হয়। ফরাসি বিজ্ঞানী বার্নার্ড কোর্টয়েজ( Bernard Courtois ) এই মৌলটি আবিষ্কার করেন। মৌল আয়োডিন বাষ্পের রঙ বেগুনি বা রক্তবেগুনী।
আয়োডিন এবং তার যৌগসমূহ প্রাথমিকভাবে পুষ্টির জন্য এবং শিল্পে এসিটিক এসিড এবং নির্দিষ্ট পলিমার উৎপাদন করতে ব্যবহার করা হয়। আয়োডিন এর অপেক্ষাকৃত উচ্চ পারমাণবিক সংখ্যা, কম বিষাক্ততার এবং জৈব যৌগসমূহের সাথে সহজে সংযুক্তির কারণে এক্স-রে এর বিপরীত উপকরণ হিসাবে আধুনিক ঔষধ বিজ্ঞানে একটি অংশে পরিণত হয়েছে। আয়োডিনে শুধুমাত্র একটি স্থিতিশীল আইসোটোপ রয়েছে। আয়োডিনের কিছু সংখ্যক রেডিওআইসোটোপ চিকিৎসাবিদ্যায় ব্যবহৃত হয়।
পৃথিবীতে আয়োডিন প্রধানত পাওয়া যায় মহাসাগর এবং সমুদ্রের পানিতে দ্রবণীয় অবস্থায় আয়োডিন আয়ন I− রূপে। অন্যান্য হ্যালোজেনের ন্যায় মুক্ত আয়োডিন দ্বিপরমাণুক(I2)। মহাবিশ্ব তথা পৃথিবীতে আয়োডিন এর উচ্চ পারমাণবিক সংখ্যা জন্য এটি একটি অপেক্ষাকৃত বিরল মৌল। তবে সমুদ্রের পানিতে উপস্থিতির জন্য এটি জীববিদ্যায়ও ভূমিকা পালন করে। প্রাথমিক ভূত্বক-উপাদান হিসাবে আয়োডিনের কম প্রাচুর্য এবং বৃষ্টির পানি মাটিতে আয়োডিনের অভাব তৈরি করে যা পৃথিবীর মানুষ তথা পশুপাখির জন্য নানাবিধ সমস্যা সৃষ্টি করে। পৃথিবীতে আয়োডিনের অভাবে প্রায় দুই কোটি মানুষ প্রভাবিত এবং মানষিক প্রতিবন্ধী ও বিকলাঙ্গতা রোগে আক্রান্ত।